Hình 1: Một số đơn vị quy đổi thông dụng trong cuộc sống
- Mol (n) là lượng chất chứa 6. 1023 nguyên tử hoặc phân tử chất đó.
- Con số 6 .1023 được gọi là số Avogadro và được kí hiệu là N.
- Ví dụ 1:
Hình 2: Một mol Sắt, nước, hiđro, đồng
- Nếu biết số mol ta có thể tính được số phân tử hoặc số nguyên tử.
- Ví dụ 2: Hãy tính số phân tử của NaCl có trong 2 mol NaCl?
- Cứ 1 mol muối có 6. 1023 phân tử muối ăn .
- Vậy 2 mol muối có 2 x 6. 1023 phân tử muối.
- Lưu ý: Phân biệt ý nghĩa của 2 cách viết sau:
- 1 mol H ⇒ Chỉ 1 mol nguyên tử Hiđro
-
1 mol H2 ⇒ Chỉ 1 mol phân tử Hiđro
Nguyên tử khối ( hoặc phân tử khối) của một chất
Khối lượng mol nguyên tử ( hoặc phân tử) của một chất
Nguyên tử khối của Fe là: 56 đvC
MFe = 56 (gam) Phân tử khối của H2 là: 1x2 = 2 đvC ({M_{{H_2}}} = 1 times 2 = 2(gam)) Phân tử khối của H2O là: 1x2 + 16 = 18 đvC ({M_{{H_2}O}} = 18(gam))- Khối lượng mol là khối lượng của N hạt phân tử hay nguyên tử chất đó.
- Khối lượng mol kí hiệu là M.
- Khối lượng mol của một chất có trị số bằng trị số của phân tử khối hoặc nguyên tử khối chất đó.
- Ví dụ:
- Khối lượng mol nguyên tử Hidro: MH = 1 gam/mol
- Khối lượng mol phân tử H2O : ({M_{{H_2}O}} = (1 times 2 + 16) = 18(gam/mol))
-
Lưu ý: Phân biệt ý nghĩa của 2 cách viết sau:
-
MN: Chỉ khối lượng mol nguyên tử Nitơ
-
({M_{{N_2}}}) : Chỉ khối lượng mol phân tử Nitơ
- Thể tích mol chất khí (V) là thể tích chiếm bởi N phân tử chất khí đó.
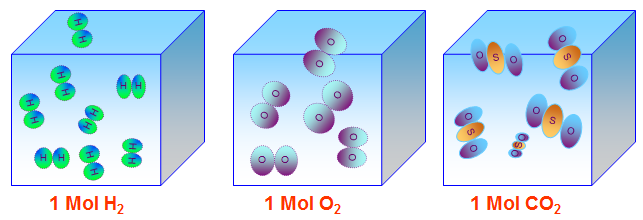
Hình 3: Mô hình của một mol chất khí bất kì trong cùng điều kiện nhiệt độ và áp suất.
- Điều kiện tiêu chuẩn (đktc): 00C và 1atm, 1 mol khí chiếm 22,4 lít
- Vậy: ({V_{{H_2}}} = {V_{{O_2}}} = {V_{C{O_2}}} = 22,4(lit))
-
Ở điều kiện bình thường là 200C và 1atm: 1 mol khí chiếm 24 lít
-
Vậy: ({V_{{H_2}}} = {V_{{O_2}}} = {V_{C{O_2}}} = 24(lit))
-
Hình 4: Sơ đồ tư duy bài Mol


.PNG)