Phản ứng K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
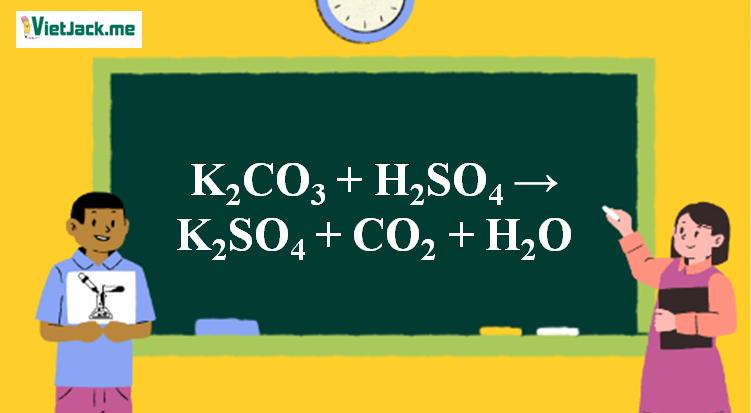
1. Phản ứng hóa học
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
2. Điều kiện phản ứng
Điều kiện thường,
3. Cách thực hiện phản ứng
Nhỏ H2SO4 vào ống nghiệm chứa K2CO3.
4. Hiện tượng nhận biết phản ứng
Có khí không màu thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K2CO3 (Kali cacbonat)
K2CO3 mang đầy đủ tính chất hoá học của muối tác dụng được với các axit mạnh.
5.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh tác dụng được với muối.
6. Tính chất hóa học của K2CO3
Là một muối của axit cacbonic và một muối yếu nên K2CO3 có tính chất sau:
- Tác dụng với axit mạnh hơn để tạo thành muối mới như CH3COOH, H2SO3, HNO3, HCl ....
- K2CO3 + 2CH3COOH → 2CH3COOK + CO2↑ + H2O
- K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
- K2CO3 phản ứng với dung dịch kiềm để tạo muối:
- K2CO3 + NaOH → Na2CO3 + KOH
- K2CO3 tác dụng với dung dịch muối để tạo muối mới bền vững hơn:
- K2CO3 + NaCl → KCl + Na2CO3
- Do là một muối axit yếu nên K2CO3 dễ bị phân hủy ở nhiệt độ cao để giải phóng ra khí cacbonic:
K2CO3 → K2O + CO2
7. Ứng dụng của K2CO3
Kali cacbonat được ứng dụng trong ngành sản xuất chất nổ, phân bón, sốm sứ thủy tinh, xà phòng, nhuộm len,... K2CO3 còn có tác dụng để làm mềm nước cứng. Bên cạnh đó, chúng còn được sử dụng trong ngành sản xuất kính và xà phòng.
8. Tính chất hoá học của H2SO4
8.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
8.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
9. Câu hỏi vận dụng
Câu 1. Nhỏ H2SO4 vào ống nghiệm chứa K2CO3 thu được hiện tượng là
A. Có khí không màu thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Lời giải:
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
CO2: khí không màu,
Đáp án A.
Câu 2. Thể tích khí ở dktc thoát ra khi cho 13,8g K2CO3 phản ứng hoàn toàn với lượng dư H2SO4 là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Lời giải:
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Câu 3. Cho 1,38g K2CO3 phản ứng hoàn toàn với lượng H2SO4, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 2,38 gam. B, 1,74 gam. C. 0,475 gam. D. 1,49 gam.
Lời giải:
khối lượng muối = 0,01.174 = 1,74gam.
Đáp án B.
Xem thêm các phương trình hóa học khác:
K2CO3 + HNO3 → KNO3 + CO2 + H2O
K2CO3 + Ba(OH)2 → KOH + BaCO3
K2CO3 + Ca(OH)2 → KOH + CaCO3
K2CO3 + CaCl2 → KCl + CaCO3
K2CO3 + BaCl2 → KCl + BaCO3


