Khí C2H2 (hay còn gọi là Axetilen) là khí quan trọng trong công nghiệp, được dùng phổ biến hiện nay với ứng dụng trong nhiều lĩnh vực khác nhau. Vậy khí C₂H₂ là gì, tính chất và ứng dụng ra sao? Hiện nay loại khí này được bán ở đâu uy tín? Hãy tham khảo thông tin dưới đây về C₂H₂ ngay nhé!
Chi tiết sản phẩm bình khí C2H2
Thành phần khí 98.5% N2 ≤1.5ppm Ar ≤1.5ppm Khác ≤ 20ppmQuy cách vận chuyển bình khí C2H2
Quy cách bình khí C2H2 Dung tích bình khí: 40L Van QF-15A1. Khí C2H2 là gì?
Axetilen hay còn gọi là C2H2 hay Acetylene là hợp chất hóa học với công thức C₂H₂. Đây là một hiđrocacbon không no; đồng thời cũng là ankin đơn giản nhất. Chất khí không màu này được sử dụng rộng rãi làm nhiên liệu và tổng hợp các hợp chất khác. Nó không ổn định ở dạng tinh khiết và do đó thường được để trong một dung dịch.
Trong dãy đồng đẳng ankin, công thức chung của dãy đồng đẳng chứa axetilen là CnH2n-2 (n ≥ 2).
Đây là loại chất có mức phổ biến khá rộng rãi làm nhiên liệu và còn dùng để tổng hợp các hợp chất khác.Công thức axetilen C2H2 không tồn tại ở dạng tinh khiết hoàn toàn mà được đựng trong một dung dịch.
Axetilen có tham gia phản ứng tráng gương không? Câu trả lời là không.
1.1. Đặc điểm cấu tạo của axetilen
- Axetilen có công thức phân tử là: C2H2
- Phân tử khối: 26
- C2H2 có bao nhiêu liên kết ba? 1 liên kết 3
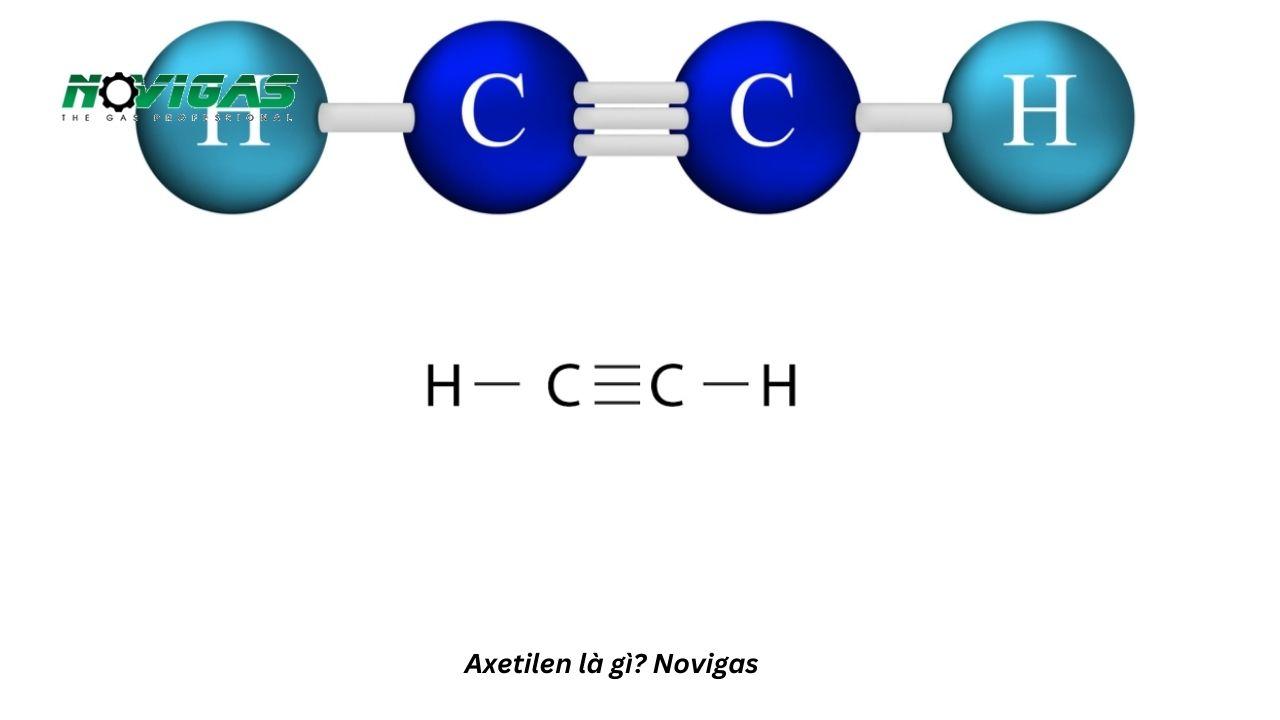
- Công thức cấu tạo của axetilen là: H - C ≡ C - H. Viết gọn HC ≡ CH.
- Trong phân tử axetilen giữa hai nguyên tử Cacbon có 3 liên kết, được gọi là liên kết ba.
- Trong phân tử C2H2 liên kết ba giữa 2 các bon gồm 2 liên kết pi (p) và 1 liên kết xích ma (s)
- Trong liên kết ba này có 2 liên kết kém bền, dễ bị đứt đoạn lần lượt trong các phản ứng hóa học hữu cơ. Đây cũng là tính chất hóa học đặc trưng của cấu tạo phân tử của axetilen.
- Một số tên gọi khác: Acetylene, Ethyne (tên hệ thống IUPAC).

1.2. Nhận biết metan etilen axetilen
Công thức cấu tạo của metan, etilen, axetilen lần lượt là CH4, C2H2, C2H4.
Phân biệt metan etilen axetilen bằng 3 bước sau:
- Bước 1: Xác định tính chất của từng loại hóa chất.
- Bước 2: Lựa chọn thuốc thử phù hợp để nhận biết etan etilen vàC2H2
- Bước 3: Trình bày phương pháp nhận biết theo trình tự như sau:
- Đánh số thứ tự cho từng lọ hóa chất.
- Tiến hành thí nghiệm để nhận biết.
- Ghi nhận hiện tượng xảy ra.
- Viết kết luận.
- AgNO3/NH3
C2H2 làm mất màu nâu đỏ của Brom.- Khi tác dụng với AgNO3, thu được kết tủa vàng
- C2H2 + Br2 → C2H2Br4- C2H2 + AgNO3 + NH3 → NH4NO3 + C2Ag2
Để phân biệt axetilen và etilen ta dùng hoặc để tinh chế khí metan có lẫn etilen và C2H2, hoặc ta dùng: khí Clo, Brom, AgNO3
2. Lịch Sử Khám Phá Axetilen
Axetilen đã được khám phá vào năm 1836 bởi nhà hóa học người Anh Edmund Davy. Ông đã tìm thấy một chất khí mới mà ông ban đầu gọi là “subcarbureted hydrogen”. Tuy nhiên, không lâu sau, nó đã được nhận diện là hydrocacbon mà chúng ta hiện biết là axetilen.
Cách sản xuất axetilen đã được cải tiến qua thời gian. Vào đầu thế kỷ 20, phương pháp sản xuất từ canxi cacbua và nước đã trở nên phổ biến. Quá trình này tạo ra một lượng lớn axetilen có thể sử dụng trong các ứng dụng công nghiệp.
Axetilen đã chứng tỏ rằng nó không chỉ là một chất hóa học thú vị mà còn có giá trị thực tế rất lớn. Nó đã trở thành một công cụ quan trọng trong việc hàn và cắt kim loại, một phần không thể thiếu trong nền công nghiệp hiện đại.
Ngoài ra, vai trò của axetilen trong tổng hợp hữu cơ cũng đã được nhìn nhận. Nó đã được sử dụng để sản xuất nhiều loại hợp chất hữu cơ khác nhau, từ hợp chất đơn giản đến phức tạp.
3. Đặc điểm cấu trúc hóa học và tính chất Axetilen C2H2
3.1. Tính chất vật lý
Axetilen có tính chất vật lý nổi bật như sau:
- C2H2 là chất khí không màu, không mùi, dễ bắt cháy và khả năng tan kém trong nước. Acetylene trong môi trường ngày nay sẽ có nhiều mùi khác nhau và mùi có thể do tạp chất tạo ra.
- Tỷ trọng của C2H2 so với không khí là D= 26/29. Điều này chứng tỏ nó nhẹ hơn không khí

3.2. Tính chất hóa học của axetilen
Phản ứng đặc trưng của axetilen là gì? Phản ứng đặc trưng của C2H2 là phản ứng cháy và phản ứng cộng
Với những đặc điểm liên kết trên, C2H2 có những tính chất hóa học đặc trưng như sau:
3.2.1. Phản ứng cháy khi tác dụng với Oxi (O2):
- Khi đốt cháy axetilen hoàn toàn sẽ tạo ra khí cacbon đioxit và hơi nước, phản ứng này tỏa nhiều nhiệt.
- Phương trình phản ứng: 2C2H2 (k) + 5O2 (k) —> 4CO2 (k) + 2H2O (h) (điều kiện nhiệt độ)
Nhận xét phản ứng cháy của C2H2: Khi đốt cháy C2H2 ta thu được số mol của CO2 lớn hơn số mol của H2O.
3.2.2. Làm mất màu dung dịch Brom (Br2)
Trong liên kết ba của phân tử axetilen (C2H2 là gì) có 2 liên kết kém bền hơn. Vì vậy, chúng tôi hy vọng axetylen sẽ làm mất màu dung dịch brom giống như etilen. Cùng làm thí nghiệm sau:
Cho axetilen đi qua dung dịch brom (Br2) ban đầu có màu da cam. Quan sát hiện tượng trên ta thấy nước brom mất màu. Từ thí nghiệm này có thể kết luận axetilen có phản ứng với dung dịch brom ban đầu

Phương trình hóa học axetilen + br2:
HC ≡ CH + Br2 —> Br-CH=CH - Br (đibrometilen)
HC ≡ CH + 2Br2 —> Br2CH-CHBr2 (tetrabrometan)
3.2.3. Phản ứng cộng Axetilen tác dụng với H2
Trong điều kiện thích hợp, axetilen còn tham gia phản ứng cộng với nhiều chất khác như H2, Cl2…
Cách thu khí etilen
- Cách 1: Sử dụng phương pháp đẩy nước, do khí etilen là chất khí ít tan trong nước.
- Cách 2: Điều chế khí axetilen từ canxi cacbua, sau đó cho tác dụng với khí Hidro có xúc tác Pd hoặc Pb.
Phương trình hóa học:
Từ phần phương pháp thu khí trên ta có phương trình hóa học xảy ra theo các cách:
Cách 1: Sử dụng phương pháp đẩy nước, do khí etilen là chất khí ít tan trong nước.
C2H5OH → C2H4 + H2O (Xúc tác của H2SO4đặc, nhiệt độ 170o C)
Cách 2: Điều chế khí axetilen từ canxi cacbua, sau đó cho tác dụng với khí Hidro có xúc tác Pd hoặc Pb.
CaC2 + 2H2O → C2H2 + Ca(OH)2
C2H2 + H2 → C2H4 (Xúc tác Pd hoặc Pb)
Cách 3: Phản ứng cộng hiđro (phản ứng hiđro hóa):
C2H2 + H2→ C2H6
Điều kiện phản ứng xảy ra C2H2 và H2: Nhiệt độ, xúc tác Niken

3.2.4.Axetilen tác dụng với AgNO3
Phản ứng Axetilen AgNO3 hoặc CH≡CH + AgNO3 + NH3 hay CH≡CH ra Ag-C≡C-Ag thuộc loại phản ứng thế bằng ion kim loại.
Phương trình phản ứng: CH≡CH + 2AgNO3 + 2NH3 → Ag-C≡C-Ag↓ + 2NH4NO3
Sục khí Axetilen vào dung dịch AgNO3 trong NH3 thu được kết tủa có màu vàng nhạt.

3.2.5. Phản ứng của axetilen với nước
Phản ứng axetilen h2o C2H2 + H2O hay C2H2 ra CH3CHO thuộc phản ứng cộng.
Cho C2H2 tác dụng với h2O, (C2H2 tác dụng với nước) ta có phương trình
PTHH Axetilen + nước: C2H2 + H2O → CH3CHO
4. Phương pháp điều chế Axetilen C2H2
4.1. Điều chế Axetilen bằng phản ứng giữa canxi cacbua và nước
Axetilen được sản xuất thông qua nhiều phương pháp, nhưng phương pháp phổ biến nhất là phản ứng giữa canxi cacbua và nước:
- Phản Ứng Hóa Học Như Sau: CaC2+2H2O→C2H2+Ca(OH)2
- Phản ứng Canxi Cacbua và Nước
Canxi cacbua được cho vào nước, tạo ra axetilen và hydroxit canxi. Quá trình này được thực hiện trong các bình chứa kín đáo, kiểm soát áp suất và nhiệt độ.
Làm Sạch Axetilen
Axetilen sau khi sản xuất chứa các tạp chất như hydrogen sulfide và phosphine cần được loại bỏ. Quá trình làm sạch thường bao gồm việc sử dụng các dung môi và bộ lọc để đảm bảo rằng axetilen tinh khiết.
Bảo Quản và Vận Chuyển
Axetilen được bảo quản trong các bình chứa dưới áp suất cao và trong dung dịch acetone. Việc này giúp giảm nguy cơ cháy nổ và giữ cho axetilen ổn định trong quá trình vận chuyển và lưu trữ.
4.2. Điều chế c2h2 trong phòng thí nghiệm
Có 3 cách thực hiện chính:
Cách 1: Sử dụng canxi cacbua (CaC2) phản ứng với nước theo phương trình phản ứng sau:
- Một vài mẩu canxi cacbua nhỏ được đặt trong ống nghiệm với 1 ml nước và nhanh chóng đậy lại bằng nút có lỗ thông hơi và đầu nhọn. Đầu ống tip tạo ra khí đốt.
- Phương trình phản ứng: CaC2 + H2O → C2H2 + Ca(OH)2
- Phương pháp này tỏa nhiều nhiệt, hàm lượng canxi cacbua chứa nhiều tạp chất (H2S, NH3, PH3,…) nên axetilen sinh ra không được tinh khiết cho lắm.

Cách 2: Cho cacbon tác dụng với hidro khi có hồ quang điện sẽ tạo ra C2H2 theo phương trình phản ứng:
2C + H2 → C2H2 (hồ quang điện)
Cách 3: Nhiệt phân metan (CH4): Ở nhiệt độ cao, sau đó làm lạnh nhanh điều chế axetilen từ metan
2CH4 → C2H2 + 3H2 (Điều kiện: 1500 °C)
Phản ứng để từ CH4 ra C2H2 có điều kiện phản ứng là nhiệt độ ở mức 1500 độ C và sản phẩm thu được làm lạnh nhanh ngay sau đó. Khí Acetylen sẽ không bị ngưng tụ khi có nhiệt độ thấp mà thay vào đó nước bị ngưng tụ nên khí thu được có độ tinh khiết sẽ cao hơn
4.3. Điều chế C2H2 trong công nghiệp
Trong công nghiệp, chúng ta có thể dùng cách nhiệt phân metan ở nhiệt độ 15000 °C (phản ứng thu nhiệt cực mạnh). Vì nhiệt độ sôi của C2H2 là -75 °C nên hóa chất này có thể dễ dàng được tách ra khỏi hỗn hợp với hidro.

- Phương trình nhiệt phân metan (CH4): 2 CH4 → C2H2 + 3 H2
- Phản ứng cacbon với hiđro khi có hồ quang điện: 2 C + H2 (cung) → C2H2
- Điều chế axetilen từ Ag2C: 2HCl + Ag2C → 2 AgCl + C2H2
- Để phản ứng canxi cacbua với axit sunfuric: CaC2 + H2SO4 → C2H2 + CaSO4
5. Ứng dụng của Axetilen
- Ứng dụng C2H2 trong ngành hàn xì. C2H2 là thành phần có nhiều trong đèn oxi-axetilen. Chúng thường được sử dụng để hàn, cắt kim loại. Hoạt động này sẽ giúp cho việc xây dựng, lắp ráp và uốn cắt kim loại trở nên dễ dàng hơn rất nhiều.
- Ứng dụng tiếp theo của C2H2 đó là làm nguyên liệu để chế tạo các loại chất hóa học.
- Axetilen còn được sử dụng phổ biến trong sản xuất ra hợp chất poly (sản xuất nhựa PVC) phổ biến hiện nay.
Lưu ý: Dùng trong đèn xì để hàn cắt kim loại là ứng dụng quan trọng nhất của C2H2. Người ta dùng đèn xì oxi axetilen để hàn cắt kim loại vì phản ứng cháy của C2H2 trong oxi sẽ tạo thành khí cacbonic và hơi nước. Nhiệt độ ngọn lửa có thể lên đến 3000°C so với khi cháy trong không khí .

5.1. Axetilen làm chín trái cây
Một công dụng cực kỳ hữu ích của C2H2 là ủ trái cây chín đều sau khi thu hoạch. Hoặc nó giúp làm chậm quá trình quả chín để bảo quản lâu hơn.
Quá trình chín của trái cây diễn ra nhanh hơn dưới tác động của khí Axetilen làm chín trái cây. Do đó người ta sử dụng nó để kích thích đẩy chín các quả hô hấp đột biến. Hoặc là những loại quả đã chín sau khi thu hoạch như cà chua, đu đu, hồng, chuối, xoài,…
5.2. Khí acetylen làm đèn chiếu sáng di động:
Canxi cacbua được sử dụng để tạo ra axetylen dùng trong các đèn xách tay (đèn cacbua). Trong thế kỷ XIX, XX, những chiếc đèn này rất hữu ích cho những người thợ mỏ và thợ lặn. Cho tới khi ánh sáng đèn sợi đốt và đèn LED ra đời và dần thay thế chúng.
Hiện nay, ứng dụng của khí acetylen làm đèn chiếu sáng này vẫn được sử dụng.Chủ yếu là ngành công nghiệp khai thác ở một số quốc gia và một số hang động sử dụng vì độ bền và khả năng chiếu sáng của chúng. Bên cạnh đó, loại đèn này còn cung cấp nhiệt. Vì vậy rất thích hợp với những vùng khai thác trong điều kiện lạnh giá hoặc hang động.
Đèn cacbua và acetylen không chỉ được sử dụng để chiếu sáng di động - đèn pha mà chúng còn được sử dụng để chiếu sáng cho các ngành khác. Trong những năm đầu thế kỷ XX, ứng dụng của khí acetylen được sử dụng cho đèn đường. Thậm chí nhiều hãng xe ô tô đã dùng để chiếu sáng cho đèn pha. Với ngành hàng hải, các ngọn hải đăng cũng từng sử dụng khí acetylen để chiếu sáng.
5.3. Ứng dụng của khí acetylen trong hàn và cắt kim loại:
Acetylen còn được dùng trong hàn và cắt kim loại. Đến ngày nay vẫn được nhiều thợ cơ khí sử dụng dù có nhiều phương tiện hiện đại thay thế do ưu thế không phải phụ thuộc nguồn điện.
Sức nóng của nguồn lửa từ acetylen là ngọn lửa hóa học có sức nóng khá lớn. Vì vậy, ứng dụng của khí acetylen trong hàn và cắt kim loại do ngọn lửa sinh ra nguồn nhiệt cao. Ưu việt của việc sử dụng thiết bị hàn oxy-acetylen:
- Hàn sắt thép mà còn có thể hàn băng
- Nung nóng kim loại
- Nới lỏng các đai ốc và bu lông dễ dàng hơn

Theo ước tính, khoảng 20% sản lượng acetylen trên thế giới sản xuất ra được sử dụng trong hàn và cắt kim loại.
5.4. Khí acetylen làm nguyên liệu chế tạo các chất hóa học:
Là một trong những thành phần để chế tạo nên các hóa chất. Nó được ứng dụng nhiều trong sản xuất công nghiệp và đời sống. Acetylen đóng vai trò quan trọng trong sản xuất vinyl clorua, vinyk axetat hoặc các monome khác. Đây là các thành phần để từ đó tổng hợp thành polime, sợi tổng hợp, cao su tổng hợp, muội than là nguyên liệu của mực trong công nghệ in ấn…
Ứng dụng tiếp theo của khí acetylen là dùng để sản xuất ra hợp chất poly hay còn gọi là sản xuất nhựa PVC. Đây là nguyên liệu để chế tạo ra các loại dụng cụ từ nhựa phục vụ sản xuất công nghiệp và đời sống sinh hoạt của con người.

5.5. Sản Xuất Nhựa
Axetilen được sử dụng trong quá trình sản xuất nhựa vinyl, một thành phần quan trọng trong ngành công nghiệp nhựa.
5.6. Trong Y Học
Trong một số trường hợp, axetilen được sử dụng như một anesthetic, mặc dù việc này đã trở nên ít phổ biến so với trước.
5.7. Khí acetylen còn được sử dụng trong tổng hợp vitamin:
Cùng với các chất axeton, amoniac NH3, hydro… và các chất có nguồn gốc sinh học, hóa học khác, thông qua quá trình tổng hợp tạo thành vitamin.
5.8. Sản Xuất Sợi
Nó cũng được sử dụng trong việc sản xuất một số loại sợi tổng hợp.
6. An Toàn và Tác Động Môi Trường
6.1. An Toàn khi Sử Dụng
Axetilen là một chất khí dễ cháy, nên việc sử dụng và bảo quản nó đòi hỏi sự cẩn thận. Phải tuân thủ các hướng dẫn và tiêu chuẩn an toàn để tránh nguy cơ cháy nổ.
6.2. Tác Động Đối với Sức Khỏe
Nếu không được xử lý đúng cách, axetilen có thể gây kích ứng cho đường hô hấp và mắt. Việc làm việc với axetilen cần sự bảo vệ và kiểm soát chặt chẽ.
6.3. Tác Động Đối với Môi Trường
Trong quá trình sản xuất và sử dụng, axetilen có thể gây tác động đối với môi trường. Việc kiểm soát và xử lý chất thải liên quan đến axetilen là một yếu tố quan trọng trong quản lý môi trường.


