
FeS + HCl → FeCl2 + H2S | FeS ra FeCl2 | HCl ra H2S
Phản ứng FeS + HCl → FeCl2 + H2S↑
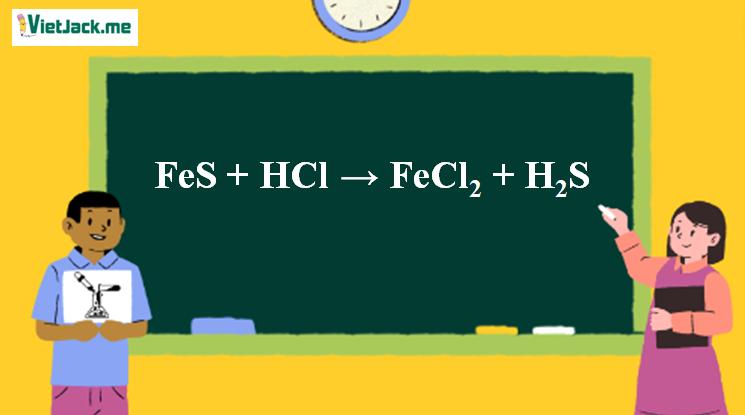
1. Phương trình điều chế H2S từ FeS
3. Điều kiện phản ứng FeS ra H2S
Nhiệt độ thường
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của FeS (Sắt (II) sunfua)
FeS có tính chất hoá học của muối tác dụng được với axit.
4.2. Bản chất của HCl (Axit clohidric)
HCl là axit mạnh tác dụng được với muối.
5. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
5.1 Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
5.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl FeCl2 + H2
2Al + 6HCl 2AlCl3 + 3H2
Cu + HCl → không có phản ứng
5.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl CuCl2 + H2 O
Fe2 O3 + 6HCl 2FeCl3 + 3H2 O
5.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
6. Mở rộng kiến thức về FeS
6.1. Tính chất vật lí và nhận biết
Tính chất vật lí:
- Là chất rắn, màu đen, không tan trong nước nhưng tan trong dung dịch axit.
- Không gây độc do không tan trong nước.
Nhận biết: Sử dụng dung dịch HCl, thấy thoát ra khí có mùi trứng thối.
FeS + 2HCl → FeCl2 + H2S
6.2. Tính chất hóa học
- Có tính chất hóa học của muối.
- Tác dụng với axit:
FeS + 2HCl → FeCl2 + H2S
6.3. Điều chế
Sắt (II) sunfua có thể được điều chế bằng cách cho hai nguyên tố là Fe và S phản ứng với nhau bằng cách đun nóng chúng.
Fe + S → FeS
6.4. Ứng dụng
Sắt (II) sunfua có nhiều trong quặng sắt, chủ yếu dùng để điều chế sắt.
7. Bài tập vận dụng liên quan
Câu 1. Người ta có thể điều chế khí H2S bằng phản ứng nào dưới đây
A. FeS + H2SO4 loãng
B. ZnS + H2SO4 đặc
C. CuS + HCl
D. PbS + HNO3
Lời giải:
Câu 2. Cho những nhận xét sau:
(1) Để điều chế khí H2S trong phòng thí nghiệm người ta cho muối sunfua tác dụng với các dung dịch axit mạnh như: HCl, HNO3, H2SO4 đặc.
(2) Dung dịch HCl đặc, S, SO2, FeO vừa có khả năng thể hiện tính khử, vừa có khả năng thể hiện tính oxi hóa.
(3) Silic đơn chất tan mạnh trong dung dịch kiềm giải phóng khí H2.
(4) Hỗn hợp BaO và Al2O3 có thể tan hoàn toàn trong nước.
(5) Cho dung dịch NaOH dư vào dung dịch Ca(HCO3)2 không thấy xuất hiện kết tủa.
(6) Hỗn hợp bột gồm Cu và Fe3O4 có thể tan hoàn toàn trong dung dịch H2SO4 loãng.
Số nhận xét đúng là
A. 5
B. 6
C. 3
D. 4
Lời giải:
Link nội dung: https://studyenglish.edu.vn/fes-hcl-a40971.html