C6H6 + Cl2 → C6H6Cl6 | C6H6 ra C6H6Cl6
Phản ứng C6H6 + Cl2 hay C6H6 ra C6H6Cl6 thuộc loại phản ứng cộng đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C6H6 có lời giải, mời các bạn đón xem:
C6H6 + 3Cl2 →as C6H6Cl6
1. Phương trình phản ứng C6H6C6 ra H6Cl6
C6H6 + 3Cl2 →as C6H6Cl6
Phản ứng này thuộc loại phản ứng cộng.
2. Hiện tượng của phản ứng C6H6 ra C6H6Cl6
- Trong bình xuất hiện khói trắng và trên thành bình thấy xuất hiện một lớp bột màu trắng (hexacloran).
3. Cách tiến hành phản ứng C6H6 ra C6H6Cl6
- Dẫn một lượng nhỏ khí clo vào bình nón chứa một ít benzen, đậy kín lại rồi đưa bình ra ngoài ánh nắng.
4. Cách viết phương trình của phản ứng C6H6 ra C6H6Cl6
Bước 1: Viết sơ đồ phản ứng.
C6H6 + Cl2 →as C6H6Cl6
Bước 2: Đếm số nguyên tử mỗi nguyên tố trong 2 vế của phương trình hóa học.
Bước 3: Đặt hệ số sao cho số nguyên tử của mỗi nguyên tố ở 2 vế bằng nhau.
Bước 4: Hoàn thành phương trình hóa học:
C6H6 + 3Cl2 →as C6H6Cl6
5. Mở rộng kiến thức về benzen
Công thức phân tử benzen: C6H6
Phân tử khối: 78
5.1. Tính chất vật lí
Benzen là chất lỏng, không màu, nhẹ hơn nước, không tan trong nước, hòa tan nhiều chất như: dầu ăn, cao su, nến, iot… Benzen độc.
5.2. Cấu tạo phân tử
- Công thức cấu tạo của benzen:
⇒ Trong phân tử benzen: Sáu nguyên tử cacbon liên kết với nhau tạo thành mạch vòng sáu cạnh đều, có ba liên kết đôi xen kẽ ba liên kết đơn.
5.3. Tính chất hóa học
a. Tác dụng với oxi
- Tương tự các hiđrocacbon khác, benzen cháy trong không khí tạo ra CO2 và H2O. Tuy nhiên, khi benzen cháy trong không khí còn sinh ra muội than.
- Phương trình hóa học:
2C6H6 + 15O2 →t012CO2 + 6H2O
b. Phản ứng thế với với brom
- Đun nóng hỗn hợp benzen và brom có mặt bột sắt, benzen phản ứng thế với brom.
- Hiện tượng: Màu đỏ nâu của brom mất đi, có khí hidrobromua bay ra.
- Phương trình hóa học:
C6H6 (l) + Br2 (l) →Fe HBr (k) + C6H5Br (l) (brom benzen)
Như vậy, nguyên tử H trong vòng benzen được thay thế bởi nguyên tử brom.
c. Phản ứng cộng
Do phân tử có cấu tạo đặc biệt nên phản ứng cộng của benzen xảy ra khó hơn so với etilen và axetilen.
Trong điều kiện thích hợp benzen có phản ứng cộng với một số chất như H2, Cl2…
Ví dụ:
C6H6 + 3H2 →Ni,t0 C6H12
5.4. ỨNG DỤNG
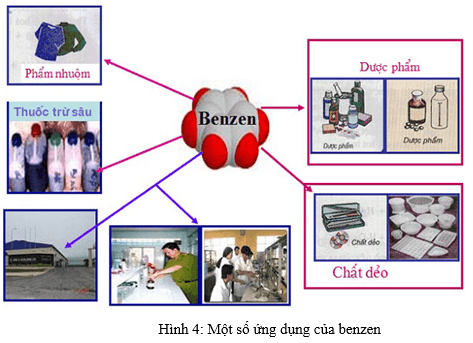
- Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu…
- Benzen được sử dụng làm dung môi trong công nghiệp và trong phòng thí nghiệm hữu cơ.
6. Bài tập vận dụng liên quan
Câu 1: Tính chất vật lý của benzen là
A. Benzen là chất lỏng, không màu.
B. Benzen độc.
C. Benzen không tan trong nước.
D. Cả A, B, C đều đúng
Hướng dẫn giải:
Đáp án D
Tính chất vật lý của benzen là
+ Benzen là chất lỏng, không màu.
+ Benzen độc.
+ Benzen không tan trong nước.
Câu 2: Trong phân tử benzen có
A. 9 liên kết đơn, 6 liên kết đôi
B. 9 liên kết đơn, 3 liên kết đôi
C. 12 liên kết đơn, 3 liên kết đôi
D. 6 liên kết đơn, 3 liên kết đôi
Hướng dẫn giải:
Đáp án B
Trong phân tử benzen có 9 liên kết đơn, 3 liên kết đôi.
Câu 3: Một hợp chất hữu cơ X có phân tử khối là 78 đvC. Vậy hợp chất hữu cơ X là
A. Benzen
B. Metan
C. Etilen
D. Axetilen
Hướng dẫn giải:
Đáp án A
Hợp chất hữu cơ X là benzen (MC6H6 = 12.6 + 6 = 78)
Câu 4: Tính chất hóa học của benzen là
A. Tác dụng với oxi.
B. Phản ứng thế với brom.
C. Phản ứng cộng.
D. Cả A, B, C đều đúng
Hướng dẫn giải:
Đáp án D
Tính chất hóa học của benzen là
+ Tác dụng với oxi.
+ Phản ứng thế với brom.
+ Phản ứng cộng.
Câu 5: Đốt cháy benzen trong không khí tạo ra CO2 và H2O có tỉ lệ là
A. 1 : 2
B. 1 : 3
C. 3 : 1
D. 2 : 1
Hướng dẫn giải:
Đáp án D
Phương trình phản ứng:
2C6H6 + 15O2 →to12CO2 + 6H2O
Theo phương trình phản ứng ta có tỉ lệ CO2 : H2O = 12 : 6 = 2 : 1
Câu 6: Đun nóng brom với 3,9 gam benzen (có bột sắt), người ta thu được 4,71 gam brombenzen. Hiệu suất của phản ứng là
A. 60%
B. 70%
C. 80%
D. 90%
Hướng dẫn giải:
Đáp án A
Số mol của C6H6 là:
nC6H6=3,978 = 0,05 mol
Phương trình phản ứng:
C6H6+Br2→ bot FeC6H5Br+HBr0,05 0,05 (mol)
Theo phương trình phản ứng ta có: nC6H5Br = 0,05 mol
Khối lượng C6H5Br trên lý thuyết là:
mC6H5Br = 0,05.157 = 7,85 gam
Hiệu suất của phản ứng là: H = 4,717,85.100% = 60%
Câu 7: Benzen có ứng dụng nào sau đây?
A. Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu…
B. Benzen được sử dụng làm dung môi trong công nghiệp.
C. Benzen được sử dụng làm dung môi trong phòng thí nghiệm hữu cơ.
D. Cả A, B, C đều đúng.
Hướng dẫn giải:
Đáp án D
Benzen có ứng dụng là:
+ Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu…
+ Benzen được sử dụng làm dung môi trong công nghiệp.
+ Benzen được sử dụng làm dung môi trong phòng thí nghiệm hữu cơ.
Câu 8: Phản ứng đặc trưng của benzen là
A. Phản ứng cháy
B. Phản ứng trùng hợp
C. Phản ứng thế với brom (có bột sắt)
D. Phản ứng hóa hợp với brom (có bột sắt xúc tác)
Hướng dẫn giải:
Đáp án C
Phản ứng đặc trưng của benzen là: phản ứng thế với brom (có bột sắt).
Câu 9: Đốt cháy 31,2 gam benzen cần dùng bao nhiêu lít oxi ở đktc?
A. 60,8 lít
B. 58,4 lít
C. 56,6 lít
D. 67,2 lít
Hướng dẫn giải:
Đáp án D
Số mol của C6H6 là:
nC6H6=31,278 = 0,4 mol
Phương trình phản ứng:
2C6H6+15O2→to12CO2+6H2O0,4 3 (mol)
Theo phương trình phản ứng ta có nO2 = 3 mol
Thể tích oxi cần dùng ở đktc là:
VO2 = 3.22,4 = 67,2 lít.
Câu 10: Cho benzen tác dụng với Cl2 (ánh sáng) ta thu được dẫn xuất clo X. Vậy X là
A. C6H5Cl
B. C6H4Cl2
C. C6H6Cl6
D. C6H3Cl3
Hướng dẫn giải:
Đáp án C
Cho benzen tác dụng với Cl2 (ánh sáng) ta thu được dẫn xuất clo X
Phương trình phản ứng: C6H6+3Cl2→ánh sángC6H6Cl6
Câu 11: Tính khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen, biết hiệu suất phản ứng đạt 80%.
A. 7,80 gam
B. 8,80 gam
C. 9,75 gam
D. 10,08 gam
Hướng dẫn giải:
Đáp án C
Số mol C6H5Br là:
nC6H5Br=15,7157 = 0,1 mol
Phương trình phản ứng:
C6H6+Br2→ FeC6H5Br+HBr0,1 0,1 (mol)
Theo phương trình phản ứng ta có: nC6H6 = 0,1 mol
Khối lượng benzen theo lý thuyết là:
mC6H6(lt)= 0,1.78 = 7,8 gam
Vì hiệu suất đạt 80% suy ra khối lượng benzen cần dùng là:
mC6H6=7,880.100= 9,75 gam.
Câu 12: Benzen và etilen có những điểm giống nhau là
A. Các hóa chất độc hại.
B. Nguyên liệu cho công nghiệp hóa học.
C. Dung môi cho nhiều chất.
D. Các hiđrocacbon không no, có thể làm mất màu dung dịch brom.
Hướng dẫn giải:
Đáp án B
Benzen và etilen có những điểm giống nhau là nguyên liệu cho công nghiệp hóa học.
Câu 13: Đun nóng brom với 15,6 gam benzen (có bột sắt), người ta thu được 21,98 gam brombenzen. Hiệu suất của phản ứng là
A. 50%
B. 60%
C. 70%
D. 80%
Hướng dẫn giải:
Đáp án C
Số mol của C6H6 là:
nC6H6=15,678 = 0,2 mol
Phương trình phản ứng:
C6H6+Br2→ FeC6H5Br+HBr0,2 0,2 (mol)
Theo phương trình phản ứng ta có: nC6H5Br = 0,2 mol
Khối lượng C6H5Br trên lý thuyết là: mC6H5Br = 0,2.157 = 31,4 gam
Hiệu suất của phản ứng là: H =21,9831,4.100%= 70%
Câu 14: Tính chất nào không phải của benzen?
A. Dễ thế
B. Khó cộng
C. Bền với chất oxi hóa
D. Kém bền với các chất oxi hóa
Hướng dẫn giải:
Đáp án D
Tính chất không phải của benzen là kém bền với các chất oxi hóa.
Câu 15: Cho các phát biểu sau:
(1) Benzen là chất lỏng, không màu, nhẹ hơn nước, không tan trong nước, hòa tan nhiều chất như: dầu ăn, cao su, nến, iot…
(2) Benzen cháy trong không khí tạo ra CO2 và H2O. Tuy nhiên, khi benzen cháy trong không khí còn sinh ra muội than.
(3) Do phân tử có cấu tạo đặc biệt nên phản ứng cộng của benzen xảy ra khó hơn so với etilen và axetilen.
(4) Benzen có ứng dụng là kích thích hoa quả mau chín.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải:
Đáp án C
Số phát biểu đúng là: (1), (2), (3)
Phát biểu (4) sai vì benzen có ứng dụng là:
+ Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu…
+ Benzen được sử dụng làm dung môi trong công nghiệp và trong phòng thí nghiệm hữu cơ.
Xem thêm các phương trình hóa học hay khác:
- C6H5CH=CH2 + Br2 → C6H5-CHBr-CH2Br
- 3C6H5-CH=CH2 +10KMnO4 →t03C6H5COOK +3K2CO3 +10MnO2↓+KOH+4H2O
- C6H5-CH=CH2 + HBr → C6H5-CH(Br)-CH3
- C6H5CH3 + Br2 →t0 C6H5CH2Br + HBr
- C6H5CH3 + 2KMnO4 →t0 C6H5COOK + KOH + 2MnO2↓ + H2O
- C6H5 + Br2 →bột Fe C6H5Br + HBr
- C6H6 + HNO3 →H2SO4 dac C6H5NO2 + H2O
- C6H5CH3 + HNO3 →C6H2(NO2)3CH3 + 3H2O
- C6H6 + 3H2 →t0, xt, Ni C6H12
- n-C6H5-CH=CH2 →t0, p, xt (CH2 -CH-C6H5)n
- 2C6H6 + 15O2 →t0 12CO2 + 6H2O
Link nội dung: https://studyenglish.edu.vn/c6h6cl2-a41852.html